

 |
Иванова Елена Александровна Санкт-Петербургский государственный политехнический университет |  |
Фазовые переходы
Краткий обзор существующих подходов к описанию фазовых переходов и структурных изменений
Проблема описания фазовых переходов давно привлекает внимание исследователей, работающих в различных областях науки: физике, термодинамике, нелинейной механике. Несмотря на различие в подходах и методах, все существующие исследования объединяет представление о том, что фазовые переходы непосредственно связаны с процессом изменения структуры вещества и характера взаимодействия на микроуровне. В настоящее время активно развивается несколько подходов к математической реализации этой концепции, каждый из которых находит свое применение в тех или иных задачах. Одним из традиционных подходов является рассмотрение резкой границы, разделяющей разные фазы. Локальная межфазная скорость вычисляется через движущую силу для границы фаз. Второй подход, в основе которого лежит теория смесей, развивается применительно к описанию химических реакций. Суть этого подхода состоит в том, что в каждой точке среды предполагается наличие нескольких веществ, которые, в зависимости от различных условий, могут взаимодействовать или не взаимодействовать между собой. Процентное содержание каждого вещества определяется концентрацией, которая представляет собой одну из основных переменных. Третий подход основан на диффузно-граничном описании, разработанным Ван-дер-Ваальсом и Каном. Микроструктурная эволюция описывается нелинейного уравнения диффузии Кана-Хилларда и зависящем от времени уравнение Гинзбурга-Ландау. Этот подход развивается, главным образом, применительно к описанию фазовых переходов, связанных не с изменением агрегатного состояния, а с изменением тех или иных физических свойств вещества. Ключевым моментом третьего подхода является использование так называемых параметров порядка. Параметры порядка иногда действительно играют роль параметров в том смысле, что они принимают одно из двух определенных значений в зависимости от того, в какой фазе находится вещество. Параметрами порядка могут быть, например, вектор электрической поляризации или намагниченность. В ряде случаев параметры порядка используются как независимые переменные, характеризующие процесс фазового перехода. Разумеется, приведенная выше классификация является в значительной степени условной в том смысле, что, например, движение фазовой границы можно описывать в рамках второго и третьего подходов, а концентрацию вещества в смеси можно рассматривать как параметр порядка. Тем не менее, классификация кажется полезной, поскольку она дает представление о различии существующих подходов и позволяет оценить то место, которое занимает представленный ниже подход среди других исследований.
Фазовый переход жидкость–газ: модель Ван-дер-Ваальса
Описание фазового перехода жидкость–газ является простейшей задачей, которая представлена в классических учебниках по равновесной термодинамике. Общепринятым является представление о том, что эта задача решается посредством использования модели Ван-дер-Ваальса:
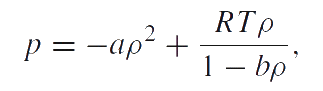 |
Фазовые диаграммы, соответствующие этому уравнению при различных значениях температуры, представлены на рисунке. При T > Tcr возможно только парообразное состояние. При T < Tcr три состояния возможны: два стабильных и одно нестабильное. В критической точке K жидкая и газообразная фазы становятся идентичными. Их температура, давление и плотность имеют значения, которые являются характеристиками каждой фазы. Точки на участке ac соответствуют равновесию жидкости и насыщенного пара. При низком давлении изотерма представляет свойств газа. На левой стороне примерно вертикальная часть изотермы соответствует жидкости, обладающей очень малой сжимаемостью. Участки ad и ec соответствуют перегретой жидкости и переохлажденному пару (метастабильное состояние). Участок ae физически не допустим, так как здесь при повышении давления объем также увеличивается.
|
Модель Ван-дер-Ваальса (изотермы вблизи критической точки равновесия) 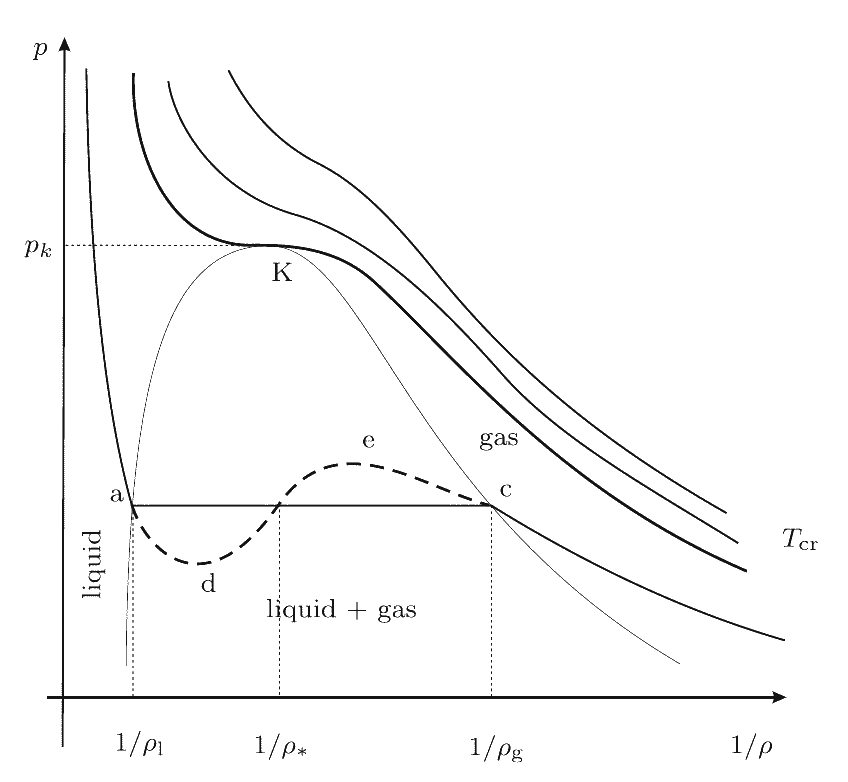 |
Хорошо известно, что критическая температура, давление и плотность связаны с параметрами моледи Ван-дер-Ваальса следующим образом:
Несложный анализ модели Ван-дер-Ваальса приводит к заключению, что существуют проблемы, которые не обсуждаются в учебниках. Например, для обычной воды
Используя эти значения критической температуры и давления, найдем параметры модели Ван-дер-Ваальса:
В заключение этого параграфа отметим, что уравнение Ван-дер-Ваальса плохо описывает поведение жидкостей. В частности, модули объемного сжатия жидкостей, вычисленные в соответствии с уравнением Ван-дер-Ваальса, оказываются отрицательными.
Перечисленные недостатки модели газа Ван-дер-Ваальса послужили мотивировкой для представленного ниже исследования. Цель исследования состоит в том, чтобы предложить модель, правильно описывающую механические и термодинамические свойства жидкости и газа, а также процесс фазового перехода. |
Основная идея предлагаемого подхода
Предлагаемый подход к описанию фазового перехода жидкость-газ [1] близок к методам, основанным на использовании параметров порядка в качестве независимых переменных. Известно, что молекулы воды и жидкостей на основе воды способны образовывать кластеры, которые ведут себя как единые молекулы большого размера. При увеличении температуры кластеры начинают распадаться и при переходе жидкости в газ кластеры полностью исчезают. Кластерные микроструктурные модели рассматривались разными авторами. Основная идея нашего подхода к описанию фазового перехода жидкость-газ состоит в том, что мы рассматриваем вещество как однокомпонентную среду, которая может находиться в жидком или газообразном состоянии. Мы вводим в рассмотрение дополнительную переменную, характеризующую количество кластеров в данной точке среды, по значению которой можно судить о том является ли вещество в данный момент времени жидкостью или газом. Эту дополнительную переменную фактически можно считать параметром порядка. Мы считаем, что фазовый переход должен сопровождаться резким изменением числа частиц, приходящихся на единицу массы (отношение плотности распределения частиц к плотности массы), происходящее вследствие того, что при температуре кипения подводимая энергия идет не на нагревание, а на структурные превращения.
Математическая формализация предлагаемого подхода. Для описания структурных изменений мы вводим в рассмотрение плотность распределения частиц как независимую переменную и для этой переменной формулируем дополнительное балансовое уравнение. Таким образом, мы формулируем два независимых уравнения баланса, а именно, уравнение баланса массы и уравнение баланса частиц:
Здесь ρ — плотность массы; η — плотность распределения частиц; χ — скорость производства частиц в единице объема. Специальный выбор источникового члена χ в уравнении баланса частиц дает возможность получить желаемое поведение этой дополнительной переменной в процессе фазового перехода. Конкретная реализация изложенного выше подхода невозможна без ясного представления о том, что подразумевается под частицей в кластерной модели жидкости. Здесь возможны две точки зрения. Согласно одной точке зрения, частицы — это либо отдельные молекулы, либо кластеры, состоящие из нескольких молекул. Таким образом, при распаде кластеров число частиц возрастает. Следовательно, в газе число частиц, приходящихся на единицу массы, больше, чем в жидкости. В соответствии с другой точкой зрения, частицы — это либо молекулы, либо гибритизированные электронные облака, посредством которых молекулы удерживаются в кластерах. Таким образом, кластер состоит из нескольких молекул (частиц, обладающих массой) и нескольких частиц пренебрежимо малой массы, моделирующих связи между молекулами в кластере. Аналогом такой модели кластера может служить система, состоящая из материальных точек, соединенных безмассовыми пружинами. Согласно этой модели, при распаде кластеров связи будут исчезать, т.е. количество частиц будет уменьшаться. Следовательно, в газе число частиц, приходящихся на единицу массы, будет меньше, чем в жидкости. Принятие одной из сформулированных точек зрения имеет принципиальное значение, поскольку отражается не только на интерпретации полученных результатов, но и на построении математической модели. Поэтому предпочтение одной из точек зрения — это не вопрос вкуса или интуитивных представлений. При выборе существенную роль играют те проблемы, которые возникают, или наоборот, не возникают в ходе математической реализации модели. Ниже представлены реализации обеих интерпретаций понятия "частица" в кластерной модели жидкости и проведен их сравнительный анализ.
Сравнение предлагаемого метода с наиболее известными описаниями фазовых переходов
Химическая термодинамика описывает фазовые переходы, основываясь на химических потенциалах и сродстве фазового превращения. Мы используем определение химического потенциала, предложенное П.А.Жилиным. Анализ различных модификаций метода Жилина, а также сравнение метода Жилина с методом Трусделла можно найти в работах [2], [3], [4]. В соответствии с одной из модификаций метода Жилина, мы считаем внутреннюю энергию аддитивной функцией числа частиц. Тогда уравнение баланса энергии (в случае жидкости и газа) сводится к следующей локальной форме:
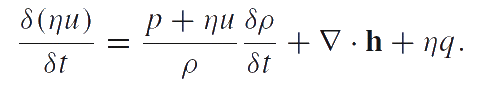
|
Здесь u — удельная внутренняя энергия; q — скорость подвода энергии в частицы среды; h — тепловой поток. Уравнение баланса энергии необходимо привести к специальной форме, которая называется приведенным уравнением баланса энергии. Введем обозначение:
Величины T и S, определенные этим уравнением, — это абсолютная температура и энтропия, приходящаяся на одну частицу, соответственно. Аналогично температуре и энтропии, η и ψ появляются в этом уравнении как сопряженные величины. Плотность распределения частиц η — измеримая величина. Сопряженная переменная ψ считается химическим потенциалом. Приведенное выше уравнение представляет собой объединенное уравнение структурных изменений (например, фрагментации) и теплопроводности. Таким образом, приведенное уравнение баланса энергии принимает вид:
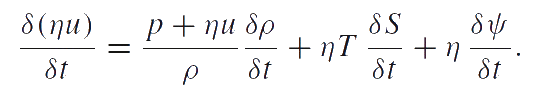
|
Определение химического потенциала Жилина отличается от классических определений. Использование этого определения позволяет считать плотность распределения числа частиц и плотность массы независимыми переменными. Именно благодаря этому оказалось возможным использовать отношение плотности распределения частиц к плотности массы в качестве параметра порядка. Кроме того, мы исходим из предположения, что фазовые переходы — это динамические процессы, и они могут быть очень быстрыми. Поэтому система основных уравнений предлагаемой модели включает уравнения движения. Вследствие этого, предлагаемый подход позволяет описывать существенно неравновесные процессы. В отличие от этого подхода, в химической термодинамике, где рассматриваются квази-равновесные процессы, испарение и конденсация моделируются при помощи уравнения Клаузиуса-Клапейрона, описывающего последовательные переходы из одного равновесного состояния в другое.
В механике сплошных сред существуют различные подходы к описанию термодинамических процессов:
Почти все известные модели описывают ситуацию, когда число частиц в среде не меняется, что означает линейную зависимость между плотностью распределения частиц и плотностью массы. В этом случае плотность распределения частиц исключается и все величины считаются аддитивными функциями массы. Мы рассматриваем плотность числа частиц и плотность массы как независимые переменные и считаем внутреннюю энергию и энтропию аддитивными функциями числа частиц, т.е. той переменной, которая связана с параметром порядка. Это обстоятельство, а также то, что идеи методов, основанных на использовании параметров порядка, соединяются с методами механики сплошных сред и применяются к описанию фазовых переходов, связанных с изменением агрегатного состояния вещества, а не его отдельных характеристик, отличает наш метод от известных подходов. Наш подход позволяет в рамках одной модели описывать оба фазовых состояния с различными механическими и термодинамическими параметрами. В то же время, наш подход дает возможность описывать поведение вещества непосредственно при фазовом переходе.
Публикации
Для просмотра PDF файлов можно загрузить бесплатную версию Adobe Acrobat Reader.